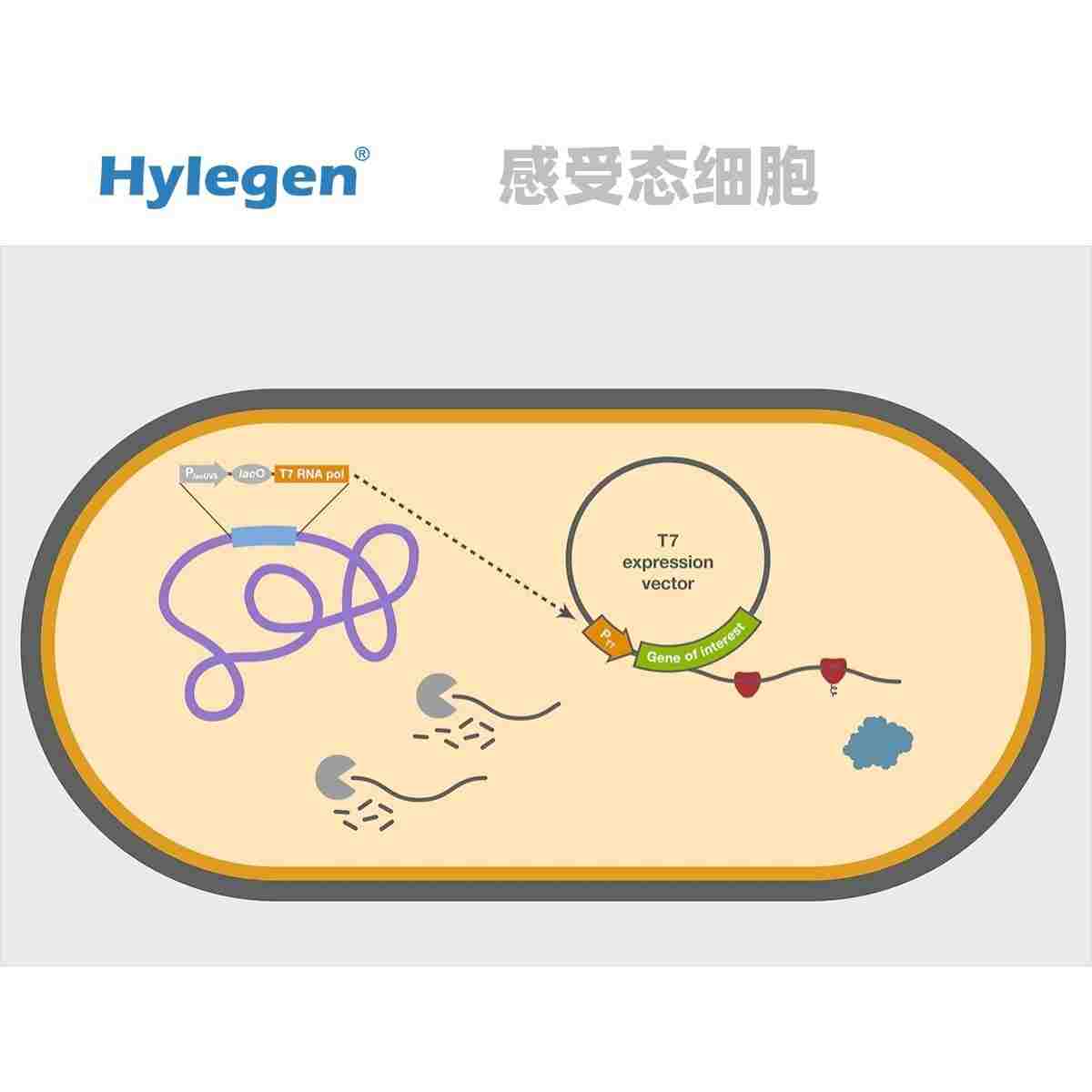
丝氨酸蛋白酶下游工艺
作者:小编
发布时间:2022-11-16
点击数:
丝氨酸蛋白酶下游工艺解决方案
丝氨酸蛋白酶是一个蛋白酶家族,它们的作用是断裂大分子蛋白质中的肽键,使之成为小分子蛋白质。在哺乳类动物里面,丝氨酸蛋白酶扮演着很重要的角色,特别是在消化,凝血和补体系统方面。其激活是通过活性中心一组氨基酸残基变化实现的,它们之中一定有一个是丝氨酸。
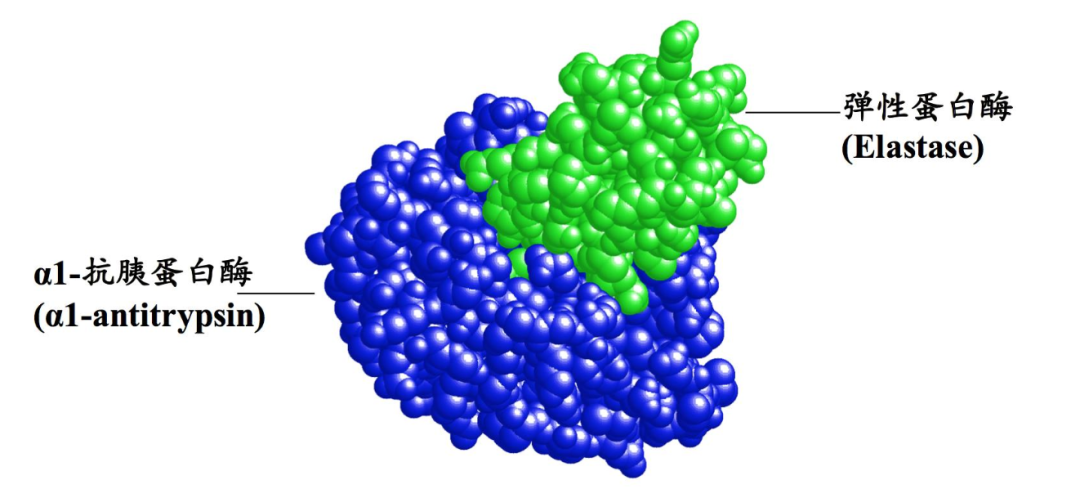
丝氨酸蛋白酶的特点是具有独特的结构,由两个在催化活性位点会聚的β-桶结构域组成。这些酶可以根据它们的底物特异性进一步分类为胰蛋白酶样、胰凝乳蛋白酶样或弹性蛋白酶样。
胰蛋白酶样
胰蛋白酶样蛋白酶在带正电荷的氨基酸(赖氨酸或精氨酸)之后切割肽键。这种特异性是由位于酶S1口袋底部的残基驱动的(通常是带负电荷的天冬氨酸或谷氨酸)。
胰凝乳蛋白酶样
胰凝乳蛋白酶样酶的S1口袋比胰蛋白酶样蛋白酶更疏水。这导致对中到大尺寸疏水残基的特异性,例如酪氨酸、苯丙氨酸和色氨酸。
类凝血酶
这些包括凝血酶、组织激活型纤溶酶原和纤溶酶。已发现它们在凝血和消化以及神经退行性疾病(如阿尔茨海默氏症和帕金森氏诱发的痴呆症)的病理生理学中发挥作用。类弹性蛋白酶
弹性蛋白酶样蛋白酶的S1裂缝比胰蛋白酶或胰凝乳蛋白酶样蛋白酶小得多。因此,残基如丙氨酸、甘氨酸和缬氨酸往往是优选的。
枯草杆菌蛋白酶
枯草杆菌蛋白酶是原核生物中的一种丝氨酸蛋白酶。枯草杆菌蛋白酶在进化上与胰凝乳蛋白酶家族无关,但具有相同的催化机制,利用催化三联体来产生亲核丝氨酸。这是用来说明趋同进化的经典例子,因为同一机制在进化过程中独立进化了两次。

上一篇:凯杰伯乐,百亿巨头合并,图啥?
下一篇:新型冠状病毒试剂盒不同检测方法分析